馬偕醫學院醫學系臨床教授
馬偕兒童醫院過敏免疫風濕科資深主治醫師
台灣遺傳性血管性水腫罕病關懷協會理事長
台灣氣喘衛教學會榮譽理事長
中華民族孝順行善關懷協會榮譽理事長
徐世達醫師
前言
在西元 1876年J.L Milton 首先發表第一個血管水腫的案例,西元 1888年Osler發表了第一個遺傳性血管水腫的案例,西元 1963年Donalson 等人發現遺傳性血管水腫與C1 inhibitor的缺乏有關。遺傳性血管性水腫(HAE)為一種罕見的原發性免疫不全症,屬於補體缺陷的免疫不全症。在西方國家盛行率可以高達五萬分之一,目前在台灣盛行率約為五十五萬分之一。遺傳性血管水腫是由C1抑制物(C1-INH)(SERPING1)缺乏一種體染色體顯性遺傳性疾病。當父母一方受到影響後代繼承50%的遺傳機率。約有25%的病例由自發性突變產生。遺傳性血管水腫的遺傳基礎是在C1抑制物有基因突變。C1-INH的基因編碼在染色體11q11-q13.1。超過700個不同的C1-INH基因突變已在遺傳性血管水腫病人被報告。遺傳性血管水腫的主要臨床表現為全身到處皆會產生的局部皮下或粘膜下水腫反覆發作。遺傳性血管水腫的發作可以經由自發性或經由誘發因子(誘發因子包括外傷、牙科手術、外科手術和緊張壓力性生活事件等)而誘發。粘膜下水腫如果涉及喉頭水腫會危及病人生命,此狀況常發生於呈現面部水腫的高危險性病人。所有HAE病人都須避免使用血管緊張素轉換酶抑製劑(ACEI)及含有estrogen的口服避孕藥。
三種HAE亞型
HAE目前分為三種HAE亞型:
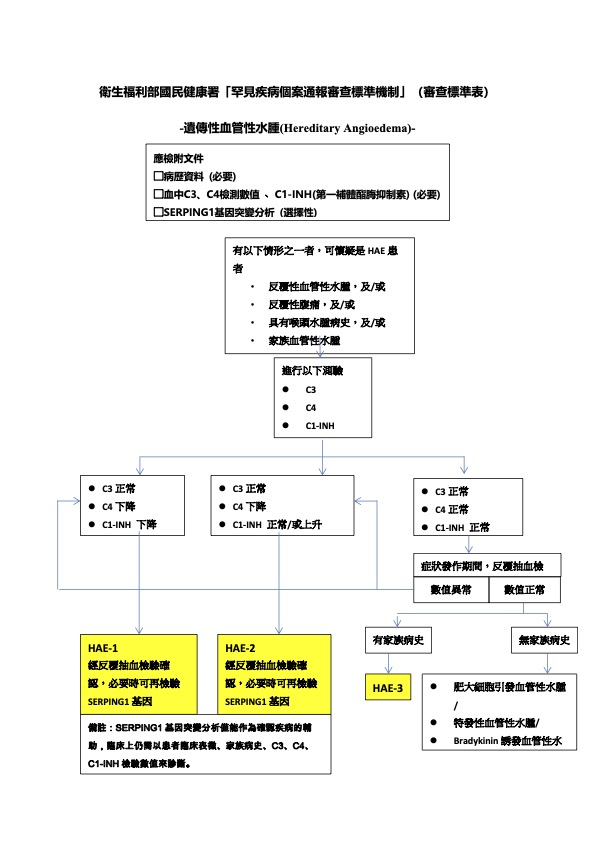
第一型C1-INH HAE,佔病例的85%,其特徵在於血清中C3正常,C4下降,抗原性C1抑制物(C1-INH)缺乏或低下。
第二型C1-INH HAE ,佔病例的15%,其特徵在於血清中C3正常,C4下降,正常的C1-INH抗原的血清濃度,但沒有功能活性或功能低下。
第三型HAE(又稱HAE nC1-INH),家族中通常有兩位或以上的反覆發作HAE病人,但是病人的C1-INH的血清濃度與功能活性皆正常。第三型遺傳性血管性水腫(HAE nC1-INH)目前已知和factor XII (FXII)、 angiopoietin (ANGPTI)、plasminogen (PLG)、kininogen-1 (KNG1) 、 myoferlin (MYOF)或heparan sulfate (HS)-glucosamine 3-O-sulfotransferase 6 (HS3ST6)的基因突變有關。第三型HAE臨床表現主要特徵為病人身體會產生不對稱的水腫外,病人會出現反覆的舌頭水腫。
第一型或第二型遺傳性血管性水腫台灣流行病學
在台灣馬偕紀念醫院,直到2023年4月,第一型和第二型遺傳性血管性水腫仍然是非常罕見的遺傳性疾病(流行率約1/534,000),總共只有16個家庭(7,4,2,3,8,1,4,2,2,1,1,4,1,1,1,1個成員)43名患者(20名男性和23名女性),並且僅發現有14個突變。病人臨床症狀呈現皮下血管性水腫,喉水腫或胃腸道水腫合併腹水,呼吸窘迫甚至窒息死亡。病人皆通過實驗室檢查和/或基因分析確定診斷為第一型或第二型遺傳性血管性水腫。
台灣馬偕紀念醫院C1-INH HAE患者,三十九名為第一型HAE,四名為第二型。沒有家族史因為新突變而產生的遺傳性血管性水腫佔4.65% (2/43)。患有臨床症狀的C1-INH血清濃度或功能低下的患者僅佔台灣地區76.74% (33/43),遠低於其他國家(95%)以前的報告。其他國外文獻報告中,腹部發作是遺傳性血管性水腫(93%的患者)中第二常見症狀,但台灣地區的腹部攻擊較少(45.45%;15/33)。我們的病人出現臉部或喉頭水腫現象的患者占(75.76%;25/33)。
第二型HAE患者的缺陷基因都位於exon 8 ,這是改變C1-INH蛋白質功能的目標蛋白酶識別位點的位置。
我們的病人當中有一例為甲狀腺機能亢進(格列夫病),她在C1-INH基因第4個外顯子具有c.685 + 1G> T突變。儘管臨床上我們其中一個家庭的病人子女皆有明顯的遺傳性血管性水腫臨床表現,但是他們父母的遺傳為嵌合現象(Parental mosaicism)所以父母皆沒有遺傳性血管性水腫的臨床表現,而且他們都呈現正常C1-INH血漿濃度與功能。我們的一位遺傳性血管性水腫女性患者在遺傳性血管性水腫發作期間會有皮膚水泡形成,甚至形成兩前臂腹面多條水泡形成,這也是全世界非常罕見的報告。在使用Danazol長期預防中,有一病人因拔牙右臉頰水腫,另一病人因拔牙窒息送急診緊急處置恢復正常。
最近我們也診斷了四例第三型HAE (又稱HAE nC1-INH) 病人,有四個家庭男女各兩例,不屬於C1抑制劑缺乏引起的遺傳性血管性水腫。其中一例病人有家族史,他的父親和弟弟皆因遺傳性血管性水腫影響氣道造成呼吸窘迫窒息死亡。病人的臨床表現包含有全身反覆不對稱性血管性水腫,頭皮、臉部、眼瞼、生殖器/會陰、臀部、四肢、嘴唇及舌頭嚴重水腫。四例病人的C3、C4、C1-INH以及SERPING1基因都正常,四例全基因外顯子掃描檢查皆屬nC1-INH HAE unknown (HAE-UNK)。
第一型和二型HAE致病機轉
第一型和二型HAE主要的致病機轉為病人先天上抗原性C1-INH缺乏或功能低下造成:(1) Coagulation cascade:凝血因子XI和IX的持續活化, 產生大量的fibrin。(2) Complement cascade:補體C4和C2的持續活化,產生大量的C3a、C5a和membrane attack complex。(3) Contact cascade:Kallikrein持續活化High-molecular-weight kininogen,間接產生大量的緩激肽(bradykinin)。因而造成病人血管擴張,微血管通透性增加,血管外水分滲出及皮下水腫。Contact cascade異常產生的超量bradykinin是造成第一型和第二型HAE (C1-INH HAE)的最重要致病機轉 (如下圖)。
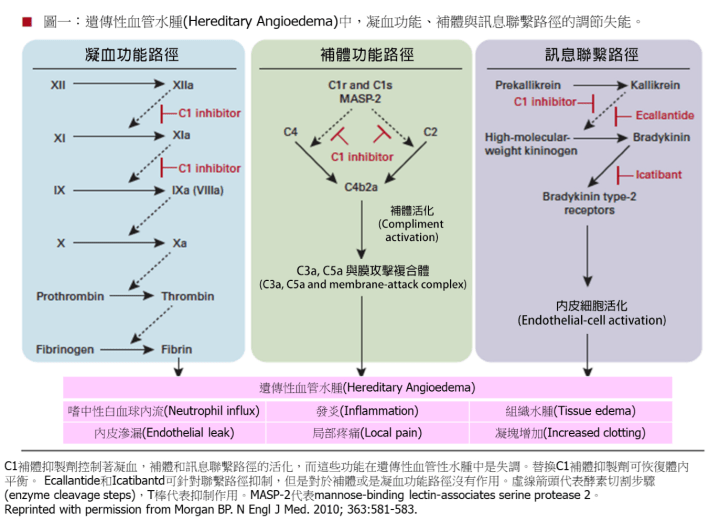
第一型和二型HAE臨床表徵
第一型和二型遺傳性血管水腫的主要臨床表現為全身到處皆會產生的局部皮下或粘膜下水腫反覆發作。常見肢體反覆嚴重不對稱性水腫,罕見合併蕁麻疹。肢體嚴重水腫會造成日常生活不便(如戴手套、戴手表與穿鞋等困難)。極度水腫甚至會造成皮膚水泡形成。病人常因反覆嚴重腹痛、腹水、無法進食,被誤診為腹部急症反覆接受不必要的腹腔手術。有些病人因反覆喉頭水腫呼吸逐漸困難,需要醫師進行緊急插管或氣管切開術,有時甚至需要住進加護病房進行緊急加護處置。嚴重喉頭水腫會危及病人生命,此狀況常發生於呈現面部水腫的高危險性病人。如果HAE病人沒有經過正確的診斷與適當的治療,有可能造成病人的生命威脅甚至死亡。
第一型和二型HAE診斷的實驗室和基因檢查
我們最初篩檢臨床呈現反覆性血管性水腫疑似患者的C3和C4血清濃度,如果病人顯示正常的C3血清濃度但是低下的C4血清濃度,則病人可能是第一型或第二型遺傳性血管水腫病人,我們會繼續進行C1-INH 的檢查。如果C1-INH血清濃度下降則為第一型HAE病人;如果C1-INH血清濃度正常則可能為第二型遺傳性血管水腫病人,接著我們可以進行 C1-INH的功能活性檢查來確定診斷是否為第二型遺傳性血管水腫病人。對於第一型及第二型的病人我們也可以進行遺傳性血管水腫病人的SERPING1基因序列突變分析來確定診斷。
第三型HAE (HAE nC1-INH)
台灣目前有四例診斷第三型HAE (HAE nC1-INH)的病例,有四個家庭男女各兩例,不屬於C1抑制劑缺乏引起的遺傳性血管性水腫。其中一例病人有家族史。病人的臨床表現包含有全身反覆不對稱性血管性水腫,頭皮、臉部、眼瞼、生殖器/會陰、臀部、四肢、嘴唇及舌頭嚴重水腫。四例病人的C3、C4、C1-INH以及SERPING1基因都正常,其中三例全基因外顯子掃描檢查皆屬nC1-INH HAE unknown (HAE-UNK)。另一例病人正等待完成全基因外顯子掃描基因檢查。在衛生福利部國民健康署「罕見疾病個案通報審查標準機制」(審查標準表)的遺傳性血管性水腫診斷流程中,我們將有遺傳家族史(家中至少有兩位患者有反覆性血管性水腫,新突變的病人例外)且本人臨床呈現反覆性血管性水腫的患者,如果病人的血液檢查顯示正常的C3、C4和C1-INH血清濃度,我們會診斷此種病例為第三型遺傳性血管性水腫病人。台灣目前確診的四例第三型HAE (HAE nC1-INH)病例,皆同時符合下列所述的國際診斷標準
第三型HAE (HAE nC1-INH) 的國際診斷標準
共識標準
- 在沒有伴隨蕁麻疹或使用已知會引起血管性水腫的藥物的情況下有復發性血管性水腫病史
- C4數值和C1抑製劑抗原數值和功能正常或接近正常
- 對高劑量抗組胺藥(例如,第二代抗組胺藥4 次/天)缺乏反應
- 已知的基因突變(factor XII (FXII)、 angiopoietin (ANGPTI)、plasminogen (PLG)、kininogen-1 (KNG1) 、 myoferlin (MYOF)或heparan sulfate (HS)-glucosamine 3-O-sulfotransferase 6 (HS3ST6)的基因突變) 或血管性水腫家族史
支持數據
- 對腎上腺素和類固醇無反應的病史
- 對緩激肽(bradykinin)靶向藥物的迅速和持久反應的病史
- 有記錄的、可見的血管性水腫,或以腹部為主的患者症狀,確定腸壁水腫證據的斷層掃描或磁共振成像
新興生物標誌物
- 閾值刺激激肽釋放酶活性
第三型HAE (HAE nC1-INH) 的診斷必須滿足所有四個共識標準。 如果沒有家族史和確定生物標誌物,需加上令人信服的支持數據才能確診。

“All four criteria must be met. If there is no family history and no biomarker has been determined, compelling supportive data may suggest the diagnosis."
N Engl J Med 2020;382:1136-48.

HAE藥物治療
HAE治療藥物
| 藥物 | 優點 | 缺點 | 最佳使用 | 認證批准狀態 |
| Plasma-derived C1-INH(血清製成的C1-INH) | Extensive clinical experience Replaces deficient C1-INH Long half-life | Infectious risk Needs IV access Limited supply Expensive as prophylaxis | Acute attacks Short-term Long-term prophylaxis Prodromes | Berinert®: FDA approved for acute attacks Cinryze®: FDA approved for prophylaxis Cetor® in the EU |
| Recombinant C1-INH(基因重組製成的C1-INH) | Replaces deficient C1-INH No human virus risk Scalable supply | Needs IV access Short half-life Potential for allergic reactions | Acute attacks Short prophylaxis Prodrome | rhC1-INH(Ruconest®): FDA approved for acute attacks |
| Ecallantide (Contact system modulators)( 激肽通路調節劑) | No infectious risk Subcutaneous administration | Antibodies may cause allergic reaction or neutralization Short half-life Box warning for anaphylaxis | Acute attacks in office or at home with a health care provider | Kalbitor®: FDA approval for administration by health care provider |
| Icantibant (Contact system modulators)( 激肽通路調節劑) | No infectious risk Stable at room temperature Subcutaneous | Short half-life Repeat dosing Local pain or irritation | Home treatment of acute attacks Ease to use during travel | Firazyr®: approved in Europe and recently in the Unites States |
| Antifibrino-lytics(抗纖維蛋白溶解藥) | Inexpensive Oral administration | Adverse effect profile Minimal to no effect | Not recommended | Not recommended |
| FFP(新鮮冷凍血清) | Inexpensive | Higher risk of viral transmission May worsen HAE attacks No controlled studies have demonstrated effectiveness | Short-term prophylaxis and for attacks | Used for acute attacks and short-term prophylaxis in HAE |
| Androgens(雄激素) | Inexpensive, oral and effective | Adverse effects are frequent Risk might outweigh benefits for doses above 200 mg a day | Short- and long-term prophylaxis | Danazol: FDA approved for HAE |
資料來源: Modified from Xu YY, et al. Clinical & Experimental Allergy
2013;43: 395–405
備註1:For C1-INH, “Limited supply” might not be an issue currently since this paper was published in 2013. “We have not reimbursement yet for HAE prophylaxis treatment in Taiwan, so it might be expensive for self-pay.”
備註2:2018年FDA認證了基因重組製成的C1-抑製劑(rhC1-INH; Ruconest®),來源於轉基因兔子的乳汁,用於治療急性遺傳性血管性水腫(HAE)發作的病患,與血漿衍生的C1-抑製劑相比,基因重組製成的C1-抑製劑具有較短的半衰期(3小時VS 24小時)。2018年FDA又認證新的治療HAE單株抗體Lanadelumab (Takhzyro ®), 用於長期預防12歲以上第一型與第二型HAE發作。Lanadelumab (Takhzyro ®)是一種血漿激肽釋放酶抑製劑(plasma kallikrein inhibitor)。 Lanadelumab (Takhzyro ®)是一種完全的人IgG1單株抗體,由重組中國倉鼠卵巢細胞(Chinese Hamster Ovary)製成。2023年2月8日FDA又核准Lanadelumab (Takhzyro ®) 擴展用於預防2歲至12歲以下遺傳性血管性水腫(HAE)病童的急性發作。Lanadelumab (Takhzyro ®)是針對2歲至12歲以下FDA核准的HAE首款預防性治療藥物。推薦劑量為150毫克/1毫升溶液,給藥方式為單次給藥預充填注射器,2歲至6歲以下病童每4週一次,6歲至12歲以下病童每2週一次。2020年12月FDA又認證新的口服長期預防HAE的治療藥物Berotralstat (Orladeyo®)。Berotralstat (Orladeyo®)是一種血漿激肽釋放酶抑製劑(plasma kallikrein inhibitor),用於長期預防12歲以上第一型與第二型HAE發作。
目前台灣可以引進的FDA 認證第一型和二型HAE治療藥物包括下列:
C1-INH(血清製成的C1-INH):Berinert® IV; Haegarda® SC; Cinryze® IV
- 適應症:Berinert® IV 500 IU/10mL, 20IU/kg, 4 mL/min; 是一人體血漿純化的濃縮C1酯酶抑制劑,用於治療急性腹部、面部或喉部的遺傳性血管性水腫(HAE)發作的病患。 Haegarda® SC 2000 IU/4mL,3000 IU/6mL,60IU/kg,2/Wk循環部位注射。用於長期預防12歲以上HAE發作。Cinryze® IV 500 U/8mL, 每3或4天靜脈注射1000U,循環部位注射。用於定期預防青少年和成人遺傳性血管性水腫發作血管性水腫(HAE)。
基因重組製成的C1-抑製劑: rhC1-INH; Ruconest® IV
- 適應症: rhC1-INH; Ruconest®,來源於轉基因兔子的乳汁,用於治療急性遺傳性血管性水腫(HAE)發作的12歲以上HAE發作病患,與血漿衍生的C1-抑製劑相比,基因重組製成的C1-抑製劑具有較短的半衰期(3小時VS24小時)。 50 U/kg,最高劑量4200 U ,靜脈注射5分鐘。 ≦2 doses within 24 hours 。
Contact system modulators (激肽通路調節劑;Icatibant):Firazyr® SC 30 mg/vial q6h,≦3 doses within 24 hours.
- 適應症:FIRAZYR® (icatibant 注射劑) 是一種緩激肽(bradykinin)B2受體拮抗劑,用於治療2 歲以上遺傳性血管性水腫(HAE)病人的急性發作。
Contact system modulators (激肽通路調節劑): Lanadelumab; Takhzyro® 300 mg SC 2 to 4 weeks;Berotralstat (ORLADEYO®) PO 150 mg QD.
- 適應症: 單株抗體Lanadelumab (Takhzyro®), 用於長期預防12歲以上第一型與第二型HAE發作。Lanadelumab (Takhzyro®)是一種血漿激肽釋放酶抑製劑(plasma kallikrein inhibitor)。 Lanadelumab (Takhzyro®)是一種完全的人IgG1單株抗體,由重組中國倉鼠卵巢細胞(Chinese Hamster Ovary)製成。Berotralstat (Orladeyo®)是一種血漿激肽釋放酶抑製劑(plasma kallikrein inhibitor),用於長期預防12歲以上第一型與第二型HAE發作。
以下對台灣將可以或即將引進的部份HAE治療藥物進行的詳細介紹
一•C1-INH(血清製成的C1-INH):
#Berinert®
血漿純化的濃縮C1酯酶抑制劑
Berinert® 500IU注射用溶液 (貝瑞寧人類C1酯酶抑制劑500)
- 適應症:Berinert®是一人體血漿純化的濃縮C1酯酶抑制劑,用於6歲以上第一型及第二型遺傳性血管性水腫 (HAE) 病患急性發作的治療。
- 用法用量:Berinert®用量為每公斤體重20國際單位(20 IU/kg bw)。劑量不應低於16 IU/每公斤體重。可經由緩慢靜脈注射給藥,也可輸注每分鐘4毫升(4 ml/min)。
- 用藥指示:Berinert®每瓶含有500國際單位(IU)的C1酯酶抑制劑白色粉末, 附有10毫升無菌注射用水。Berinert®僅供靜脈注射用。速率為每分鐘4毫升。
- 用於兒童:在安慰劑對照和開放延長試驗中,針對27位HAE(年齡範圍在6至17歲間)的兒科患者,進行Berinert®的安全性和有效性評估。在美國和歐洲進行的一項註冊研究試驗中,18位(年齡範圍小於12歲)及21位(年齡範圍在12至17歲間)有HAE的兒科患者也進行了Berinert®評估。在兒科族群中觀察到的安全性與成人試驗觀察到的情況相似。
- 用於老年人:在美國和歐洲進行的一項註冊研究試驗中,27位老年患者(年齡範圍65歲至83歲間)使用Berinert®被評估。在老年族群中觀察到的安全性與在較年輕族群試驗觀察到的情況相似。
- 注意事項:
過敏症
對於已知易過敏的病人,應給予抗組織胺及皮質類固醇藥物做為預防治療。如果發生過敏性反應(allergic or anaphylactic-type reactions),應立即停用BERINERT®並給予適當的治療。依據不良反應的類型及嚴重度選擇療法,遵循現行醫學標準的休克治療。
併用禁忌
本藥品不得與其他藥物及注射器/輸注套組的稀釋液混合使用。
儲存注意事項
避光儲存於 30°C 以下。不可冷凍。配製後的藥品應立即使用。如果未能立 即施用,請存放於藥瓶內,切勿於室溫下存放 8 小時以上。 - 懷孕等級:懷孕等級為C。Berinert®是人類血漿中的生理成分。因此,未曾有試驗針對動物探討生殖及發育毒性,而且預期對人類的生育能力、產前及產後發育沒有不良反應。Berinert®只有在明確需要的情況下才應給予懷孕婦女。
- 不良反應:Berinert®臨床試驗的受試者中,觀察到常見的不良反應是頭痛、腹痛及嘔吐。
- 禁忌症:Berinert®不可使用在對C1酯酶抑制劑及其賦形劑(甘胺酸、氯化鈉及檸檬酸鈉)有過敏性反應的病患。
#Cinryze®
血漿純化的濃縮C1酯酶抑制劑
Cinryze® 500IU注射用溶液
- 適應症:Cinryze®是一種C1酯酶抑製劑,用於定期預防青少年和成人遺傳性血管性水腫發作血管性水腫(HAE)。
- 用法用量:Cinryze®用於定期預防HAE之劑量為每3或4天靜脈注射1,000U。
- 用藥指示:Cinryze®每8mL小瓶中含500U凍晶粉末,附有USP規格的5毫升兩瓶無菌注射用水。Cinryze®僅供靜脈注射使用,速率為每分鐘1毫升。
- 用於兒童:Cinryze®的安全性和有效性尚未在新生兒,嬰兒或兒童中確立。在隨機交叉、安慰劑對照、用於定期預防HAE的臨床試驗24名受試者中,僅有3名年齡在18歲以下(9歲,14歲和16歲)。
- 用於老年人:在隨機交叉、安慰劑對照、用於定期預防HAE沒有包括足夠數量的65歲以上的受試者來確定他們是否對年輕受試者的反應不同。
- 注意事項:避光保存在2OoC‧建議使用無矽注射器。不可冷凍‧溶解後可於室溫存放。
- 懷孕等級:懷孕類別C。沒有動物數據可用。目前尚不清楚CINRYZE對孕婦是否會造成胎兒危害或可能影響生殖能力。 Cinryze®只有在明確需要的情況下才可以給予孕婦。
- 不良反應:Cinryze®臨床試驗的受試者中,觀察到的最常見的不良反應是頭痛,噁心,皮疹和嘔吐。
- 禁忌症:Cinryze®不可使用在對C1酯酶抑制劑製劑有過敏性反應的病患。
#Haegarda®
血漿純化的濃縮C1酯酶抑制劑
Haegarda® 2000IU注射用溶液
- 適應症:Haegarda®是一人體血漿純化的濃縮C1酯酶抑制劑,用於六歲以上青少年及成年C1酯酶抑制劑缺乏之遺傳性血管性水腫(HAE)病患的預防性治療。
- 用法用量:Haegarda®用量為每3或4天皮下注射每公斤體重60國際單位(60 IU/kg bw)。
- 用藥指示:Haegarda®每瓶含有2000國際單位(IU)的C1酯酶抑制劑白色粉末, 附有4毫升無菌注射用水。Haegarda®僅供皮下注射用。
- 用於兒童:在隨機交叉和安慰劑對照的臨床試驗中,針對11位HAE(年齡範圍在8至17歲間)的兒科患者,進行Haegarda®的安全性和有效性評估。在兒科族群中觀察到的安全性與成人試驗觀察到的情況相似。目前FDA建議可以使用在6歲以上的HAE長期預防。
- 用於老年人:在隨機交叉和安慰劑對照的臨床試驗中,10位老年患者(年齡範圍65歲至72歲間)使用Haegarda®被評估。在老年族群中觀察到的安全性與在較年輕族群試驗觀察到的情況相似。
- 注意事項:
過敏症
對於已知易過敏的病人,應給予抗組織胺及皮質類固醇藥物做為預防治療。 如果發生過敏性反應(allergic or anaphylactic-type reactions),應立即停用Haegarda®並給予適當的治療。依據不良反應的類型及嚴重度選擇療法,遵循現行醫學標準的休克治療。
併用禁忌
本藥品不得與其他藥物及注射器/輸注套組的稀釋液混合使用。
儲存注意事項
避光儲存於 30°C 以下。不可冷凍。配製後的藥品應立即使用。如果未能立即施用,請存放於藥瓶內,切勿於室溫下存放 8 小時以上。 - 懷孕等級:懷孕等級為C。Haegarda®是人類血漿中的生理成分。因此,未曾有試驗針對動物探討生殖及發育毒性,而且預期對人類的生育能力、產前及產後發育沒有不良反應。Haegarda®只有在明確需要的情況下才應給予懷孕婦女。
- 不良反應:Haegarda®臨床試驗的受試者中,觀察到常見的不良反應是注射部位反應、頭暈及鼻炎。
- 禁忌症:Haegarda®不可使用在對C1酯酶抑制劑及其賦形劑(甘胺酸、氯化鈉及檸檬酸鈉)有過敏性反應的病患。
二•Contact system modulators (激肽通路調節劑;Ecallantide):
#Kalbitor®
Plasma kallikrein inhibitor (血漿激肽釋放酶抑制劑)
Kalbitor® 10毫克注射用溶液
- 適應症:Kalbitor®(ecallantide) 係用於治療 12 歲以上遺傳性血管性水腫 (hereditary angioedema, HAE) 病患之急性發作。
- 用法用量:建議劑量:Kalbitor®之建議劑量為 30 毫克 (3 毫升),亦即三瓶 10毫克 (1 毫升) 注射劑,以皮下注射給藥。若該次發作仍持續,可於 24 小時內追加注射 30 毫克。
- 用藥指示:
- Kalbitor®只能由醫護專業人員在足以處理無防禦性過敏反應和遺傳性血管性水腫的適當醫療環境下使用。
- Kalbitor®應冷藏避光保存。Kalbitor®為澄清、無色液體,給藥前須先目測檢查每個藥瓶裡是否有顆粒物和變色的情形。若有顆粒物或變色,則該瓶藥品不可使用。
- 以無菌技術用大口徑針頭從藥瓶抽出 1 毫升 (10 毫克) 的 Kalbitor®。將針筒上的針頭更換為適用於皮下注射的針頭,建議使用尺寸為 27 號的針頭。由腹部、大腿或上臂的皮膚注入 Kalbitor®。重複此步驟以完成 Kalbitor®三瓶劑量的給藥。可選擇注射在相同或不同的解剖部位 (腹部、大腿、上臂),而不須輪換注射部位。注射部位之間應該距離至少2英吋 (5公分) 遠,並遠離發作的解剖部位。
- 在24小時內追加的給藥劑量以同樣方式投予。可注射在不同的部位,亦可注射於與第一次給藥相同的解剖部位。
- 根據群體藥物動力學分析,體重、年齡和性別對Kalbitor®暴露都不會產生明顯的影響。
- 用於兒童:
- Kalbitor®用在 12 至 17 歲病患的安全性和有效性已得到確立。從 16 歲以上病患的療效外推,加上藥物動力學分析顯示成人和青少年的藥物暴露水準相當,由此得以證明Kalbitor®用在 12-15 歲族群的療效。在 12-17 歲的兒科病人中觀察到的安全性貌與在整個臨床試驗族群所觀察到的不良反應雷同。
- Kalbitor®用在低於 12 歲的病患之安全性和有效性尚未經確立。
- 用於老年人:
- Kalbitor®臨床試驗收錄的 65 歲以上受試者數目並不足以確定他們的反應是否和年輕受試者不同。老年人更常有肝、腎臟或心臟功能下降的情形,或常伴隨其他疾病,或使用其他藥物治療,一般情況下,應謹慎選擇老年病人的用藥劑量,通常從最低劑量開始使用。
- 注意事項:
- 懷孕等級:C
- 不良反應:接受Kalbitor®治療的病患曾有發生包括無防禦性過敏反應在內的過敏反應之報告。
- 禁忌症:請勿將Kalbitor®用於已知臨床上對Kalbitor®過敏的病患。
三•Contact system modulators (激肽通路調節劑 ; Icatibant):
#Firazyr®
Bradykinin B2 receptor inhibitor (緩激肽 B2受體阻斷劑)
Firazyr® 30毫克注射用溶液
- 適應症:Firazyr®(icatibant 注射劑) 是一種緩激肽(bradykinin)B2受體拮抗劑,用於治療2歲以上遺傳性血管性水腫(HAE)病人的急性發作。
- 用法用量:
- 以30毫克在腹部皮下注射。
- 如果反應不足或症狀復發,則需要以至少6小時的間隔施以額外注射30毫克。
- 在24小時內不要注射超過3次。
- 患者可在自我認知為HAE急性發作時自行給藥。
- 用藥指示:
- Firazyr®預填充注射器內的藥物,應為澄清無色。如果其溶液包含顆粒、混濁或為異常顏色,請勿使用Firazyr®預填充注射器。
- 處理注射所需的任何物品之前,以肥皂和清水清洗雙手,且一律謹慎處理備品以避免污染。
- 用於兒童2歲以上遺傳性血管性水腫(HAE)病人的急性發作使用。
- 用於老年人:
由於其他報告的臨床經驗,並未發現在療效和老年和年輕患者之間的安全差異,建議無需調整劑量。 - 注意事項:
- 懷孕等級:C
- 不良反應:
- 最常見的副作用包括:注射部位的發紅、瘀青、腫脹、發熱、瘙癢、發炎、蕁麻疹、麻木、壓迫或疼痛以及發燒、血液中含有過多的轉氨酶、頭暈、噁心、頭痛、皮疹
- 禁忌症:無
- 鑑於當急性喉部HAE發作會有氣道阻塞的風險,除了施打Firazyr®治療,建議患者應立即至適當的醫療機構就醫。
- 保存:
- 存放在36°F到77°F(2°C 到 25°C)之間,請勿冷凍
- 準備使用之前,將Firazyr®存放在原本的紙盒中
- 不需要混合
四•Contact system modulators (激肽通路調節劑 ; Lanadelumab):
#Takhzyro®
Plasma kallikrein inhibitor (血漿激肽釋放酶抑制劑)
Takhzyro® 300毫克注射用溶液(12歲以上)
Takhzyro® 150毫克注射用溶液(2-12歲;FDA Feb. 8, 2023核准)
*Lanadelumab是透過DNA重組技術,在中國倉鼠卵巢(Chinese Hamster Ovary,CHO)細胞中製造。
- 治療適應症:Takhzyro®適用於12歲以上病人(台灣),做為遺傳性血管性水腫(hereditary angioedema,HAE)反覆發作的預防。 說明:須符合以下三者之一:
- 曾經有過1個月發作3次(含)以上
- 6個月發作達到5次
- 曾有過危及生命之發作
- 用法用量:本藥品應在有遺傳性血管性水腫(HAE)病人處置經驗的醫師監督下開始使用。
劑量
12歲以上建議的起始劑量為每2週一次300毫克lanadelumab。針對在治療中穩定無發作的病人,尤其是體重較輕的病人,可考慮劑量調降為每4週一次300毫克lanadelumab。Takhzyro®不適用於治療急性HAE發作。若錯過一劑TAKHZYRO,應指示病人盡快注射該劑量,確保注射間相隔至少10天。
Takhzyro® 150毫克注射用溶液(2-12歲;FDA Feb. 8, 2023核准)
6至12歲每2週一次150毫克lanadelumab。
2至6歲每4週一次150毫克lanadelumab。
用法
Takhzyro®僅適用於皮下(subcutaneous,SC)注射。每一個Takhzyro®藥瓶僅限單次使用。注射應限於建議的注射部位:腹部、大腿,以及上臂的外側。建議輪流選用注射部位。只有在經過專業醫療人員的皮下注射技術相關訓練後,才可以自行注射或由照護者注射Takhzyro®。 - 老年人:不預期年齡會影響lanadelumab之暴露量。不需要為65歲以上病人調整劑量。
- 兒童族群:Takhzyro® 150毫克注射用溶液(2-12歲;FDA Feb. 8, 2023核准)。
6至12歲每2週一次150毫克lanadelumab。
2至6歲每4週一次150毫克lanadelumab。
12-17歲兒童病人之lanadelumab平均暴露量,約會較成年人在給予相同劑量下之平均暴露量高約37%,此差異為兒童病人體重較輕之原因。另,若是體重較輕之12-17歲兒童病人,其lanadelumab暴露量會較同年齡層兒童的平均暴露量高約2.5-2.8倍,此暴露量約為成年人平均暴露量的3.2倍;於體重較輕之兒童病人應謹慎使用。 - 特殊警語及使用注意事項
可追溯性
了提高生物藥品的可追溯性,應清楚記錄所注射藥品的名稱和批號。
過敏反應
曾觀察到過敏反應。若發生嚴重過敏反應,應立即停止施打Takhzyro®,且必須採取適當的治療。
一般情況
Takhzyro®不適用於治療急性HAE發作。若發生突發性HAE發作,應使用經核准的救援藥物開始個人化治療。對具有正常C1酯酶抑制蛋白(C1 esterase inhibitor,C1-INH)活性的HAE病人使用lanadelumab,目前並無臨床資料。
干擾凝血檢測
由於lanadelumab與活化部分凝血活酶時間(activated partial thromboplastin time,aPTT)檢驗間的交互作用,lanadelumab會增加aPTT。在aPTT實驗室檢測中使用的試劑,會透過活化接觸系統中的血漿激肽釋放素(kallikrein)來引發內源性凝血。在此分析中,以lanadelumab抑制血漿激肽釋放素會增加aPTT。使用TAKHZYRO治療的病人中,其aPTT的增加與並未伴隨異常出血不良事件治療組之間的國際標準化比值(international normalised ratio,INR)並無差異。
鈉含量
本藥品每小瓶含有少於1毫莫耳的鈉(23毫克),即實質上「無鈉」。 - 生育力、懷孕與授乳
懷孕
在孕婦使用lanadelumab方面,目前並無資料或資料有限。動物試驗並未顯示對生殖或發育毒性有直接或間接的有害影響。做為預防措施,宜避免在懷孕期間使用lanadelumab。
哺餵母乳
目前並不清楚lanadelumab是否會分泌至人類乳汁中。已知人類免疫球蛋白G (IgG),會在分娩後的最初幾天當中分泌至母乳中,之後很快下降到低濃度;因此,在這一段短時間內,不能排處對哺餵母乳小孩的風險。之後若臨床上有需要,可在哺餵母乳期間使用lanadelumab。
生育力
尚未對人類評估lanadelumab對生育力的影響。Lanadelumab對於馬來猴的雄性或雌性生育力不具影響。 - 不良反應
觀察到與Takhzyro®有關的最常見(52.4%)不良反應,是注射部位反應(injection site reaction,ISR),包括注射部位疼痛、注射部位紅斑及注射部位淤血。在這些注射部位反應中,97%為輕度,90%在發作後1天內緩解,持續時間中位數為6分鐘。 - 禁忌症
對其活性物質或任何賦形劑(二水合磷酸氫二鈉、單水檸檬酸、組胺酸、氯化鈉、聚山梨醇酯80、注射用水)過敏。
五•Contact system modulators (激肽通路調節劑 ; Berotralstat):
#Orladeyo®
Plasma kallikrein inhibitor (血漿激肽釋放酶抑制劑)
Orladeyo® (Berotralstat) 150毫克口服膠囊)
- 適應症:Orladeyo®適用於預防成人和12歲及以上兒童患者遺傳性血管性水腫 (HAE)的發作。
- 用法用量:一般推薦劑量為每日口服一錠150毫克膠囊,隨食物口服。
- 用藥指示:Orladeyo®是每錠150毫克之口服膠囊,需存放於20°C – 25°C之間,也可暫時放置在15°C – 30°C之間。
- 用於兒童:Orladeyo®用於預防遺傳性血管性水腫發作的安全性和有效性已在 12 歲及以上的兒科患者中得到證實。在該人群中使用Orladeyo®得到了一項充分且對照良好的研究證據支持,該研究包括12歲以上至未滿18歲的青少年患者和成人患者,研究中青少年患者的安全性概況和發作率與在成人患者中觀察到的相似。尚未確定Orladeyo®在未滿12歲兒童患者的安全性和有效性。
- 用於老年人:在一項臨床試驗(試驗1)中,在9名65歲以上的次群組患者中評估了Orladeyo®的安全性和有效性,按年齡進行的次群組分析結果與總體研究結果一致。在另外一項臨床試驗(試驗2)中,有5名65歲以上的老年患者參加了開放標籤、長期安全性研究,其安全性特徵與試驗1的數據一致。
- 注意事項:
當劑量高於推薦的每日一次150毫克劑量時,可能會發生QT間期延長。 不推薦額外劑量或高於每天一次150毫克的Orladeyo®劑量。 - 懷孕等級:未指定。
孕婦:沒有足夠的孕婦數據來告知懷孕期間使用Orladeyo®的藥物相關風險。
授乳:沒有關於人乳中存在berotralstat、其對母乳餵養嬰兒的影響或其對產奶量的影響的數據。 - 不良反應:最常見的不良反應 (≥10%) 是腹痛、嘔吐、腹瀉、背痛和胃食道逆流症。
- 禁忌症:無。
目前台灣可以處方的HAE治療藥物
在台灣,我們只有雄激素(Danazol)、抗纖維蛋白溶解藥(Transamic acid; TXA)(此藥不能有效地治療我們的第一型和二型HAE病人)、新鮮冷凍血漿(FFP)和Icatibant(Firazyr®)可供病人使用。Icatibant(Firazyr®)用於治療2歲以上通過國建署與健保署的罕見疾病和重大傷病認證的遺傳性血管性水腫(HAE)病人的急性發作使用。
1. 對於急性期遺傳性血管水腫的治療:
避免誘發因子合併藥物治療是遺傳性血管性水腫病人的最佳處置方式。 緊急藥物的使用(on demand therapy)則可使用隨身攜帶的皮下注射Icatibant(FIRAZYR®)(2歲以上)。也可自行靜脈注射血漿純化的濃縮C1酯酶抑制劑Berinert®(6歲以上) 或攜帶醫師處方的Berinert®到媒合醫院進行靜脈注射處置。Icatibant(FIRAZYR®)是一種緩激肽(bradykinin)B2受體拮抗劑。Icatibant(FIRAZYR®) (2歲以上)與C1酯酶抑制劑Berinert®(6歲以上) 目前專案用於治療通過國建署與健保署的罕見疾病和重大傷病認證的遺傳性血管性水腫(HAE)病人的急性發作。如果沒有Icatibant(FIRAZYR®)或C1酯酶抑制劑Berinert®可以急救,則需使用兩個單位的FFP治療。此劑量可以重複每兩至四個小時,直到有臨床改善。有時病人需要加護病房呼吸治療、插管和氣管切開術。
2. 對於短期/術前預防治療:靜脈注射血漿純化的濃縮C1酯酶抑制劑Berinert®於手術或檢查前1-12小時使用。另外可以使用Danazol每天200 – 400毫克於接觸誘發因子5-7天前至事件發生後2天。
3. 對於長期預防治療:HAE第一線用藥目前只有Lanadelumab (Takhzyro ®)通過台灣藥證,但是尚未取得健保給付。目前台灣使用Danazol來長期預防第一型和二型病人。 Danazol用量可高達200毫克,每日三次;但是我們通常對男性病人使用Danazol每天400毫克,但對女性則(為避免男性化)每天使用 200毫克。如果臨床穩定,我們會逐漸將Danazol減少至每兩天200毫克 。Danazol的劑量是根據臨床反應調整,而不是根據C4或其他實驗室測試結果調整。對於長期預防治療,第三型HAE病人雖然也可以使用雄激素(Danazol等)做為HAE長期預防的藥物,但是第三型HAE病人使用抗纖維蛋白溶解藥(Transamic acid; TXA)每天1500毫克的長期預防HAE效果比雄激素(Danazol等)藥物的效果好。
目前台灣使用Danazol來長期預防HAE病人臨床症狀時,用藥前遺傳性血管水腫病人需要進行血壓,肝功能,甲型胎兒蛋白(αFP)和體內脂質濃度初步監測,治療期間每6個月再進行監測,肝臟超音波檢查每12個月進行一次。
第一型和二型HAE藥物治療的使用時機
按需治療(On-Demand Treatment)
所有的HAE發作導致人體導致虛弱/功能障礙時和/或涉及面部,頸部或腹部的發作都應考慮進行按需治療。以免造成身體嚴重傷害窒息或生命危險。對於這樣的HAE發作,我們建議越早使用按需治療越好。避免誘發因子合併藥物治療是遺傳性血管性水腫病人的最佳處置方式。 緊急藥物的使用(on demand therapy)則使用隨身攜帶的皮下注射Icatibant(FIRAZYR®)或到醫院注射的靜脈注射血漿純化的濃縮C1酯酶抑制劑Berinert®來處置。Icatibant(FIRAZYR®)是一種緩激肽(bradykinin)B2受體拮抗劑。隨身攜帶自我皮下注射的Icatibant(FIRAZYR®)目前專案用於治療2歲以上通過國建署與健保署的罕見疾病和重大傷病認證的遺傳性血管性水腫(HAE)病人的急性發作。按需治療的急救藥物HAE病人最理想是要隨身攜帶兩份治療劑量,同時要建議患者使用按需治療急救藥物後應立即至適當的醫療機構就醫。若病人呈現進行性上呼吸道水腫的病程考慮儘早進行插管或氣管切開術。第三型HAE病人也可以使用Icatibant(Firazyr®)進行急救。如果沒有Icatibant(FIRAZYR®)或C1酯酶抑制劑Berinert®可以急救,則需使用兩個單位的FFP治療。此劑量可以重複每兩至四個小時,直到有臨床改善。 有時病人需要加護病房呼吸治療、插管和氣管切開術。
短期/術前預防(Short-term/Preprocedural Prophylaxis)
身體創傷和情緒壓力是手術不可避免的後果,也是HAE發作的公認最重要誘因。與手術相關的腫脹通常發生在事件發生後4至30小時。由於腫脹通常發生在手術創傷部位附近,因此牙科手術對HAE上呼吸道水腫發作最有相關性,因此牙科手術被認為具有誘發HAE上呼吸道水腫發作窒息甚至造成死亡的特別高的風險。
HAE病人若有經常腫脹的病史; 進行以往會造成腫脹病史的類似手術,進行牙科或其他口內手術; 手術有插管的必要性; 或更具侵入性的手術皆需要進行術前預防。短期預防也被建議使用於有情緒壓力時期,考試或類似情況的高風險時期。
我們建議使用C1-抑製劑(Berinert®),雄激素(Danazol或Stanozolol )或Tranexamic acid (TA)做為HAE短期/術前預防的藥物。在手術前1至12小時,使用C1-INH濃縮液Berinert®(20 U / kg體重或1000 U)。雄激素在HAE可能誘發事件發生前5天和發病後2至5天使用(Danazol 2.5-10 mg/kg體重/天,最大600 mg)。口服TA(未完全建立)為25mg / kg,每日2至3次,每日最多3至6g。
病例報告和系列病人的統計報告顯示,儘管進行了短期/術前預防,即使在相對較小的手術後也可能發生HAE病人的急性發作、上呼吸道水腫、窒息甚至造成死亡。所以所有的HAE病人在作這些手術時,皆須隨時準備有按需治療的急救藥物。
長期預防(Long-term Prophylaxis)
長期預防HAE是指使用常規藥物預防HAE患者血管性水腫的發作。長期預防須考慮到疾病的嚴重程度,發作頻率,患者的生活品質,資源的可用性以及病人使用適當的按需治療後仍無法充分控制HAE急性發作病情,這樣的HAE患者都需要考慮使用長期預防藥物。
我們建議最好能使用血清製成的C1-抑製劑(Haegarda®、Cinryze®等) 、Lanadelumab (Takhzyro ®)、Berotralstat (Orladeyo®)等第一線HAE長期預防藥物。但是只有Lanadelumab (Takhzyro ®)目前通過台灣藥證,但是尚未取得健保給付。台灣目前只能使用其他非第一線藥物:例如雄激素(Danazol)使用於第一型和二型HAE病人、抗纖維蛋白溶解藥(Transamic acid; TXA)使用於第三型HAE病人做為HAE長期預防的藥物。
目前的HAE病人使用長期藥物預防方式,並無法確定能完全預防HAE病人的急性發作、上呼吸道水腫、窒息甚至造成死亡。所以所有在接受HAE長期預防的病人,也是都需要隨時準備有按需治療的急救藥物。
結論
為促進維持HAE病人能獲得更好的醫療處置方式,我們需要教育所有的醫護人員,要及早認知並診斷臨床上呈現反覆性水腫的病人是否是遺傳性血管水腫病人。確定診斷HAE病人以後,必須給予病人完整的衛教:教導病人如何避免誘發因子,學會按需治療急救藥物的使用;如何認知HAE病情中重度的嚴重發作,以便能及時正確使用HAE急救藥物,來避免危及生命的不幸事件發生。
在治療藥物方面目前有效的急救藥物包括C1 INH(Berinert®等)、Ecallantide (Kalbitor®)、Icatibant (Firazyr®)和新鮮冷凍血清(FFP)。目前台灣只有Icatibant (Firazyr®)和Berinert®可以處方。C1 INH(Berinert®) 急性發作時的用量是經由靜脈注射體重每公斤不小於20 國際單位(IU)劑量。成人HAE病人在急性發作時我們可以用1000至2000單位靜脈注射,有 69%的病人在注射後半小時內緩解症狀,超過九成的病人在注射後 4小時內症狀完全緩解,如果沒有C1 INH(Berinert®等)、Ecallantide (Kalbitor®)、Icatibant (Firazyr®)等的藥物,也可以輸新鮮冷凍血漿,至於腎上腺素,抗組織胺及類固醇等藥物對遺傳性血管水腫沒有明顯的幫助。若病人因危險發作或發作頻率過高的話我們平常可以給予病人做長期預防的藥物來做預防,盡量減少發作的次數,最常拿來做第一線長期預防的藥物是血清製成的C1-抑製劑(HAEGARDA® 、CINRYZE®等)、Lanadelumab (Takhzyro ®; 已經取得藥證尚未健保給付)或是Berotralstat (Orladeyo®)等。目前台灣只有非第一線藥物可以使用包括雄激素(Danazol)使用於第一型和二型HAE病人、抗纖維蛋白溶解藥(Transamic acid; TXA)使用於第三型HAE病人。Danadol長期使用病人的副作用包括毛髮增加、體重增加、月經不規則、高血壓、乳房體積減小及肝腫瘤等。抗纖維蛋白溶解藥(Transamic acid)不建議用於第一行和第二型HAE的長期預防,因為缺乏支持其療效的數據。但是有些學者會使用於不適合用androgen的第一型和二型HAE病人。HAE病人若有經常腫脹的病史; 進行以往會造成腫脹病史的類似手術,進行牙科或其他口內手術; 手術有插管的必要性; 或更具侵入性的手術皆需要進行短期/術前預防。我們建議可以使用C1-抑製劑(Berinert®),雄激素(Danazol)或Tranexamic acid (TA)來做為HAE短期/術前預防的藥物。我們一定要記得所有HAE的病人包括在接受HAE短期/術前預防或長期預防的病人,都需要隨時準備有按需治療的急救藥物,以避免HAE病人因急性發作、上呼吸道水腫、窒息甚至造成死亡的悲劇發生。尤其是我們必須教導病人和醫療服務提供者當面對遺傳性血管水腫病人呈現面部水腫時就表示此遺傳性血管水腫病人是會出現喉頭水腫並危及生命的最高危險性病人。另外遺傳性血管水腫的病人都須避免使用血管緊張素轉換酶抑製劑及含estrogen的口服避孕藥。
第三型HAE病人使用抗纖維蛋白溶解藥(Transamic acid; TXA)每天1500毫克的長期預防HAE效果比雄激素(Danazol等)藥物的效果好。
遺傳性血管水腫實際病例報告與討論
一位 16 歲小女孩因為最近兩年來發生無數次不明原因的臉部水腫而從外面 的診所轉介至馬偕小兒過敏免疫科來做進一步的追蹤與治療。根據病人描述每 次發生水腫的期間大約持續3 至7 天,且病人的伯父在三十多歲時因為突發性 的喉頭水腫窒息而死亡。病人的伯父在生前也曾發生無數次的臉部與喉頭不明 原因的血管水腫。在實驗室診斷上我們發現這位16 歲小女孩血清內的補體C4 <10 mg/dL,C3:111mg/dL, C1 easterase inhibitor:6.5mg/dL,我們把病人整 個家族做血清的C1 esterase inhibitor 濃度發現家族中尚有五位親戚也有C1 easterase inhibitor 低下的情況。
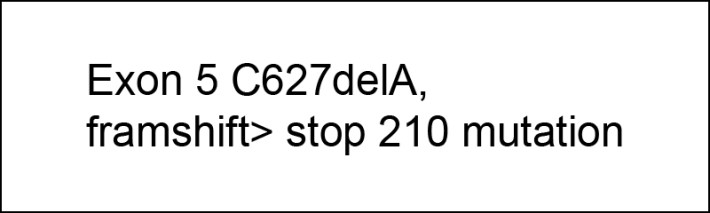
同時我們這位 16 歲病人的血液做C1 inhibitor 的基因檢測發現病人在 第11 對染色體上面的C1 inhibitor 基因的codon 210 處發生單點缺失突變造 成codon 210 處反而形成終止密碼(C627delA, framshift> stop 210)。經診 斷為第一型遺傳性血管水腫。
病人家族史:








遺傳性血管性水腫疾病活動度評分量表(HAE-AS)一
● 姓名:
● 評估日期:
● 遺傳性血管性水腫疾病活動
1. 您過去6個月內發作的次數?
● 0. 沒有發作
● 1. 1至5次
● 2. 6至20次
● 3. 大於20次
2. 您過去6個月內腹部症狀發作的次數?
● 0. 沒有發作
● 1. 1至5次
● 2. 6至20次
● 3. 大於20次
3. 您過去6個月內臉部腫脹發作的次數?
● 0. 沒有發作
● 1. 1至20次
● 2. 大於20次
4. 您過去6個月內生殖器官腫脹發作的次數?
● 0. 沒有發作
● 1. 1至5次
● 2. 6至20次
● 3. 大於20次
5. 您過去6個月內上呼吸道腫脹發作的次數?
● 0. 沒有發作
● 1. 1至20次
● 2. 大於20次
6. 您過去6個月內其他部位腫脹發作的次數?
● 0. 沒有發作
● 1. 1至20次
● 2. 大於20次
7. 您過去6個月內遺傳性血管性水腫發作須接受治療的發作次數?
● 0. 沒有發作
● 1. 1至20次
● 2. 大於20次
8. 您過去6個月內是否有遺傳性血管性水腫發作須至急診就醫次數?
● 0. 沒有發作
● 1. 1至10次
● 2. 大於10次
9. 您過去6個月內是否有因第一、第二型遺傳性血管性水腫,接受過心裡和/或精神諮詢治療?
● 0. 否
● 1. 是
10. 您過去6個月內是否有因第一、第二型遺傳性血管性水腫導致未就學或上班的天數?
● 0. 0天
● 1. 1至5天
● 2. 6至5天
● 3. 大於15天
11. 您上個月的整體健康狀況?
● 0. 非常好
● 1. 很好
● 2. 普通
● 3. 糟糕
12. 上個月是否因為疼痛而影響?
● 0. 非常好
● 1. 很好
● 2. 普通
● 3. 糟糕
●
●
● 遺傳性血管性水腫疾病活動度總分:__________
●
●
● 說明:
● 總分9分以下表示輕度遺傳性血管性水腫疾病活動度
● 總分9-12分表示中度遺傳性血管性水腫疾病活動度
● 總分12分以上表示嚴重遺傳性血管性水腫疾病活動度
遺傳性血管性水腫(HAE)台灣診療指引2024年01月版
徐世達醫師
馬偕醫學院醫學系臨床教授
馬偕兒童醫院過敏免疫風濕科資深主治醫師
台灣遺傳性血管性水腫罕病關懷協會理事長
台灣氣喘衛教學會榮譽理事長
中華民族孝順行善關懷協會榮譽理事長